СЕЛФ |
22 |
| С.Б. Каравашкин и О.Н. Каравашкина | |
|
|
СЕЛФ |
22 |
| С.Б. Каравашкин и О.Н. Каравашкина | |
|
|
5. Анализ феноменологического описания энтропии Как известно, феноменологическое описание понятия энтропии непосредственно связано с понятием работы, производимой над некоторой термодинамической системой. “К сожалению, принятая в настоящее время терминология не вполне удачна. Действительно, термины “работа” и “теплота” имеют двоякий смысл. С одной стороны, работа и теплота - это две различные формы передачи энергии, а с другой - количество переданной энергии. Поэтому во втором случае правильнее было бы говорить не о “совершённой работе” или “сообщённом количестве теплоты”, а об энергии, переданной, соответственно, в форме работы или в форме теплоты. Однако в дальнейшем, ради краткости, там, где это не вызывает путаницы, мы будем пользоваться общепринятой терминологией, вкладывая в неё вышеуказанный смысл” [10, с. 193]. Как известно, “Первое
начало термодинамики представляет частный
случай закона сохранения энергии в применении к
тепловым процессам. Если количество тепла,
получаемое системой и выраженное в механических
единицах, равно |
| (12) |
где (- При этом “в основу
молекулярной теории тепловых свойств вещества
мы положим следующее весьма естественное
допущение: “Внутренняя энергия
макроскопического тела тождественно со средней
энергией Учитывая ранее
проанализированные аспекты, несложно увидеть
ограниченность данных формулировок, применимых
исключительно к локальным системам, в которых
пренебрегают источниками энергии, даже такими
как химическая энергия, не говоря уже об
источниках глобального характера. В то же время,
в частности, “химические
процессы характеризуются переносом не только
энергии, но и вещества. Поэтому, рассматривая,
например, изобарный потенциал, необходимо
учитывать, что изменение количества молей
какого-то компонента при сохранении постоянного
количества всех остальных компонентов и при
постоянных T и p будет на какую-то
величину изменять значение изобарного
потенциала. Приращение количества химической
энергии при реакции будет выражаться как
произведение Математически химические потенциалы представляют собой частные производные характеристических функций по числу молей данного компонента системы при постоянных значениях независимых параметров и количеств остальных компонентов: |
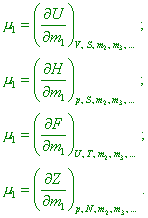 |
(13) |
(где dU, dH, dF, dZ - приращение внутренней энергии системы, энтальпии, свободной энергии системы и изобарного потенциала соответственно - авт.) Химический потенциал можно рассматривать как работу химических сил, совершаемую при изменении количества какого-то компонента в системе при постоянстве параметров и массы всех остальных компонентов” [17, с. 26]. С учётом данной особенности изменяется и математическая запись первого начала термодинамики (12). “Когда система обладает n степенями свободы, закон сохранения и превращения энергии можно записать в виде приращения внутренней энергии системы, приравненного к сумме всех n количеств взаимодействия: |
| (14) |
или через параметры состояния |
| (15) |
[17, с. 16]; здесь dQ - изменение теплоты в системе, dA - работа, произведенная системой, de - изменение заряда системы. Из приведенной записи (14), (15) следует, что в термодинамической системе могут присутствовать некоторые источники энергии, и не только локальные, к которым относится химическая энергия, но и такие глобальные, как ранее рассмотренная нами энергия самопроизвольного сжатия вещества данной системы. При этом Бабушкин правильно записал закон сохранения в форме (14), выразив внутреннюю энергию системы через все внутренние и внешние влияющие факторы, поскольку эти факторы изменяют внутреннюю термодинамическую энергию системы и зачастую могут быть совсем не связанными с введенным в данную систему количеством тепла. Теперь мы уже не имеем права представить температуру в системе в виде [17, с. 24] |
| (16) |
поскольку энтропия характеризует, согласно (15), только изменение параметров системы вследствие воздействия внешних тепловых источников, а внутренняя энергия в общем случае изменяется как под действием внешних, так и под действием внутренних источников и температура системы зависит от этого комплексного воздействия. Ограничиваясь же только постоянством объёма, как и записывая первый закон термодинамики в стандартном виде (12), мы фактически связываем подведенное извне количество тепла с полным изменением внутренней энергии системы. Поэтому связь между изменением внутренней энергии и энтропией системы справедлива исключительно при отсутствии внутренних источников, способных изменять термодинамический баланс системы. Если же, как в случае с химической энергией, в результате реакции температура системы понизилась или повысилась, в связи с чем изменилась и производимая системой работа, то энтропия данную особенность учесть уже не способна, поскольку она характеризует только изменение кинетической энергии ансамбля вследствие подвода или отвода тепла от системы. Аналогично и в случае самопроизвольного гравитационного сжатия. Появляющееся при этом излучение, как было нами установлено, обусловлено исключительно внутренней энергией ансамбля молекул, а точнее, их гравитационным взаимодействием. На кинетическую энергию ансамбля это в исходном состоянии до начала сжатия не влияет, но влияет на концентрацию плотности энергии, образующейся в результате сжатия, которую возможно оценить на основе расчётов зависимости давления в однородном теле, приведенном нами в [18]. |
Содержание: / 18 / 19 / 20 / 21 / 22 / 23 / 24 / 25 / 26 / 27 /